MIASTENIA GRAVIS - Causas, Síntomas y Tratamiento


La miastenia gravis (MG) es una enfermedad neuromuscular de origen autoinmune, que en su forma más común provoca grados variables de cansancio y debilidad muscular, que alcanzan preferentemente los músculos de contracción voluntaria, tales como los de los brazos, piernas, cara, ojos y los músculos torácicos responsables de la respiración.
La debilidad muscular asociada a la miastenia gravis habitualmente se agrava después de la actividad física o cuando el paciente está más cansado, como, por ejemplo, al final del día. Los síntomas tienden a mejorar con el reposo.
La miseria es una enfermedad grave, pero que en las últimas décadas ha sido adecuadamente controlada con nuevos esquemas de tratamiento, lo que ha permitido que la mayoría de los pacientes se mantengan activos y con calidad de vida.
En este artículo vamos a explicar lo que causa la miastenia gravis, cuáles son sus síntomas, cómo se hace su diagnóstico y cuáles son los tratamientos actualmente disponibles.
¿Qué es miastenia gravis?
La miastenia gravis es una enfermedad de origen autoinmune provocada por un defecto en la transmisión de los impulsos nerviosos a los músculos. Una enfermedad autoinmune surge cuando nuestro sistema inmunológico comienza a producir auto-anticuerpos de forma inapropiada, es decir, anticuerpos que van a atacar y destruir elementos y estructuras sanas de nuestro propio organismo (si desea profundizarse en el tema, lea el siguiente artículo: ENFERMEDAD AUTOIMUNE - Causas, Síntomas y Tratamiento).
En la miastenia gravis, el sistema inmunológico produce anticuerpos que dañan los receptores musculares que reciben las señales producidas por los nervios. Vamos a explicar cómo funciona la interacción entre los nervios y los músculos para que usted entienda mejor el origen de esta enfermedad.
Como los auto-anticopros provocan la miastenia gravis
Toda contracción muscular que usted realiza es controlada por impulsos nerviosos que se originan en el cerebro. Usted sólo consigue levantar el brazo, mover la cabeza o caminar, por ejemplo, porque su cerebro es capaz de enviar impulsos eléctricos que viajan por la médula, alcanzan los nervios periféricos y llegan hasta las fibras musculares que necesitaban ser activadas. Una persona que sufre un traumatismo de la columna y tiene una grave lesión de la médula puede dejar de caminar porque las señales eléctricas que salen del cerebro ya no alcanzan los músculos de las piernas.
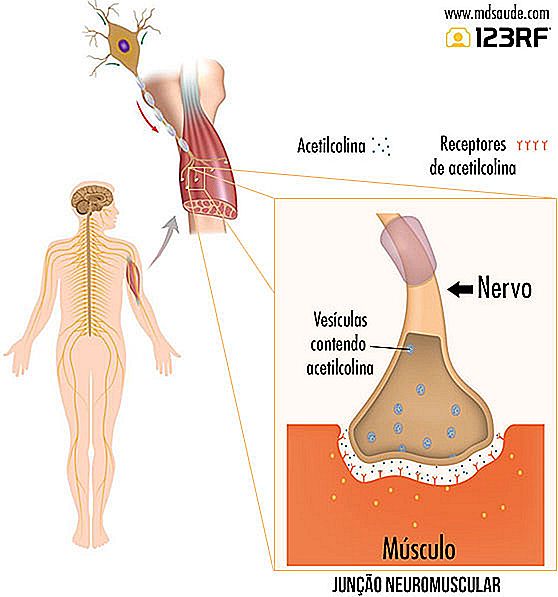
En la miastenia gravis, el problema no ocurre en la médula, sino en el final del recorrido, cuando las fibras nerviosas se conectan a las fibras musculares. En realidad, los nervios no se conectan directamente con el músculo, hay un pequeño espacio entre la terminación nerviosa y la fibra muscular, que se llama unión neuromuscular. Acompañe la ilustración al lado para entender mejor.
Cuando el impulso nervioso llega a la terminación nerviosa, él estimula la liberación de un neurotransmisor llamado acetilcolina. La acetilcolina cae en la unión neuromuscular y es captada por los receptores de acetilcolina presentes en el músculo. Es la acetilcolina captada en la unión neuromuscular que estimula la contracción muscular.
La miastenia gravis es una enfermedad que ocurre cuando, por motivos aún desconocidos, el sistema inmunológico comienza a producir anticuerpos contra los receptores de acetilcolina presentes en los músculos. La acción de los autoanticuerpos puede llevar a la destrucción o daño de hasta el 80% de estos receptores, lo que disminuye drásticamente la capacidad de captación de acetilcolina, principalmente durante el esfuerzo, que es cuando el músculo necesita de mayores cantidades del neurotransmisor para funcionar .
¿Quién suele tener miastenia gravis?
La miastenia gravis es una enfermedad poco común, que afecta a unas 100 a 400 personas para cada grupo de 1 millón de habitantes (0, 01 a 0, 04% de la población).
La miastenia gravis puede ocurrir a ambos sexos, pero es más común en el sexo femenino: cada 5 personas enfermas, 3 son mujeres. Además de ser más común en las mujeres, la MG también suele atacar más temprano en este grupo, generalmente en la 3ª década de vida. La edad media de apertura del cuadro en las mujeres es de 28 años.
En el sexo masculino, la enfermedad es más común a partir de la 5ª década de vida, siendo 42 años la edad media de inicio de los síntomas. Esta diferencia de edad en la apertura del cuadro hace que a partir de los 50 años, la miastenia gravis pase a ser más común en el sexo masculino.
Los recién nacidos, hijos de madre con miastenia, pueden tener una forma transitoria de MG, llamada miastenia gravis neonatal, que surge como resultado del paso de los auto-anticuerpos maternos por la placenta. Esta forma de MG dura pocas semanas, que es el tiempo que el organismo del bebé lleva para eliminar los anticuerpos maternos enfermos. Si es diagnosticado y tratado adecuadamente, más del 90% de los bebés se curan y sin secuelas. Raramente, la miastenia gravis en recién nacidos ocurre por enfermedad del propio recién nacido.
Una serie de estudios han sugerido una asociación de miastenia gravis con otras enfermedades autoinmunes, tales como neuromielitis óptica, enfermedades autoinmunes de la tiroides, lupus eritematoso sistémico y artritis reumatoide.
Síntomas de la miastenia gravis
La principal característica de la miastenia gravis es un cuadro de fatiga muscular limitado a determinados grupos musculares, que puede ser fluctuante, es decir, con períodos de mejora alternados con fases de agravación. La fatiga muscular de la MG no se manifiesta como una sensación generalizada de cansancio, sino como disminución aislada de la fuerza de algunos músculos.
La debilidad muscular puede variar a lo largo del día, siendo habitualmente peor por la noche o después de algún ejercicio. Al principio de la enfermedad, los síntomas pueden estar ausentes al despertar, surgiendo con el avance del día. Conforme la enfermedad progresa, los períodos libres de síntomas desaparecen. El paciente pasa a tener debilidad en todo momento, sólo varían de gravedad a lo largo del día.
Aunque la miastenia puede producir debilidad en cualquier agrupación muscular de contracción voluntaria, hay ciertas formas de presentaciones que son bastante características, como veremos a continuación.
Síntomas oculares
Más del 50% de los pacientes presentan síntomas oculares al inicio de la enfermedad, senda de ptosis (caída del párpado) y la diplopía (visión doble) más comunes. Entre los pacientes que abren el cuadro con manifestaciones oculares, la mitad desarrollará enfermedad generalizada dentro de dos años.
En aproximadamente el 15% de los casos, el paciente presenta sólo síntomas oculares, no evolucionando a enfermedad generalizada. Este cuadro se llama miastenia gravis ocular.
Síntomas de la cara y del cuello
El 15% de los pacientes presentan síntomas relacionados con los músculos de la cara y del cuello, que incluyen: disartria (dificultad para articular palabras y frases), disfagia (dificultad para tragar), falta de fuerzas para masticar y pérdida de las expresiones faciales.
La debilidad del cuello también es común, haciendo que el paciente tenga dificultad para mantener la cabeza erguida.
Síntomas de los miembros
El acometimiento de los miembros es común, pero la debilidad aislada de algún miembro ocurre en menos del 5% de los casos. Cuando los miembros son acometidos, el paciente también suele tener debilidad en otros grupos musculares del cuerpo. La debilidad en los brazos y las manos es más común que en las piernas.
Síntomas respiratorios
La participación de los músculos respiratorios produce los síntomas más graves de miastenia gravis. La debilidad muscular respiratoria puede conducir a la insuficiencia respiratoria o hasta la parada respiratoria, una situación grave que se llama la crisis miasténica.
La crisis miasténica puede surgir espontáneamente durante las fases de agravación de los síntomas o puede ser precipitada por varios factores, incluyendo cirugías, traumas, infecciones o medicamentos. Ente los fármacos que pueden provocar agravamiento de la miastenia y un mayor riesgo de crisis miasténica podemos citar:
- Antibióticos: aminoglucósidos (por ejemplo, gentamicina o neomicina), quinolonas (por ejemplo, ciprofloxacino, levofloxacino y norfloxacino), vancomicina, azitromicina y clindamicina.
- Anestésicos que hacen bloqueo muscular.
- Betabloqueantes (por ejemplo, atenolol, labetalol, metoprolol y propranolol).
- Toxina botulínica (lea: BOTOX - Uso Cosmético y Terapéutico).
- La cloroquina.
- La quinina.
- Procainamida.
- El magnesio.
Evolución natural de la miastenia gravis
En el inicio de la enfermedad, los síntomas suelen ser transitorios, logrando al paciente quedarse horas, días o incluso semanas asintomáticas. Sin embargo, con el paso de los meses, las manifestaciones tienden a empeorar y se vuelven más persistentes. Cerca del 80% de los pacientes alcanzan el pico de la enfermedad dentro de los 3 años.
La evolución de la miastenia gravis puede dividirse en tres fases:
- En los primeros 3 a 5 años de enfermedad, hay una fase activa con fluctuaciones y agravamiento progresivo de los síntomas. La mayoría de las crisis miasténicas ocurren en esta fase de enfermedad. Más de la mitad de las muertes provocadas por la miastenia ocurren en los primeros años.
- La segunda fase es una fase de estabilización. El paciente mantiene los síntomas, pero no se ponen peores. Las agudizaciones sólo suelen ocurrir en el contexto de infecciones, el uso de medicamentos que agravan la debilidad muscular o cambios en la estrategia de tratamiento de la miastenia, como la reducción de la dosis de los medicamentos, por ejemplo.
- Algunos pacientes evolucionan a la fase 3, en la cual puede ocurrir remisión total de la enfermedad, quedando el paciente libre de síntomas con o sin la necesidad de mantener el tratamiento medicamentoso.
Diagnóstico de la miastenia gravis
El diagnóstico de la miastenia gravis se realiza a través del examen neurológico, que puede incluir la prueba del hielo o la prueba del edrofonio, junto con exámenes complementarios, como la electroneuromiografía.
Prueba del hielo
La prueba del hielo se puede hacer en aquellos pacientes con caída del párpado. Se coloca una bolsa de hielo recostada en el párpado acometida por 2 minutos. El enfriamiento del músculo mejora la transmisión neuromuscular, haciendo que el paciente pueda volver a abrir el ojo temporalmente. Esta prueba funciona en aproximadamente el 80% de los pacientes.
Prueba del edrofonio
El edrofonio es un fármaco con acción anticolinesterásica. Esto significa que inhibe la degradación de la acetilcolina presente en la unión neuromuscular, aumentando el tiempo que los pocos receptores de acetilcolina todavía presentes en el músculo tienen para captar el neurotransmisor. El aumento de la viabilidad de la acetilcolina ayuda al paciente a recuperar transitoriamente la fuerza muscular. La acción del edrofonio, que se administra por vía intravenosa, se inicia después de unos segundos y dura de 5 a 10 minutos.
La prueba del hielo acaba siendo más utilizado que el del edrofonio, por este último tener un mayor riesgo de efectos colaterales, como desencadenamiento de asma o de eventos cardíacos.
Sorología - Dosificación de los autoanticuerpos
Dos tipos de autoanticuerpos se pueden encontrar en la sangre de pacientes con miastenia gravis: anticuerpos anti-receptor de acetilcolina (Anti-ACH), que es el más común de autoanticuerpos MG, y anticuerpos quinasa específica anti-tirosina de cierta músculos (MuSK-AB), que son detectable sólo en una minoría de casos.
80 a 90% de los pacientes con MG generalizada poseen anti-ACh positivos. En los cuadros de miastenia gravis ocular, la positividad de auto-anticuerpo es de sólo 40 a 50%.
El anticuerpo MuSK-Ab es mucho menos común, pero puede estar presente en hasta el 50% de los pacientes con miastenia generalizada, pero con anti-ACh negativo. En los casos de miastenia ocular, el anticuerpo MuSK-Ab suele ser negativo.
Sólo el 10% de los pacientes con miastenia gravis son llamados suero-negativos, es decir, tienen ambos auto-anticuerpos negativos. Los pacientes suero-negativos suelen tener una forma de enfermedad más blanda, generalmente limitada a los ojos.
Tratamiento de la miastenia gravis
El tratamiento de la miastenia gravis suele ser hecho con una combinación de diferentes fármacos, que actúan sobre la enfermedad de forma distinta. Los más comunes son:
1- Inhibidores de la colinesterasa
Son medicamentos en comprimidos que actúan aumentando el tiempo de viabilidad de la acetilcolina en la unión neuromuscular, mejorando la capacidad y la fuerza de contracción muscular. El más utilizado es la piridostigmina.
Los Inhibidores de la colinesterasa tienen eficacia variable, siendo muy buenos para algunos pacientes, pero poco efectivos para otros. Este tipo de tratamiento actúa puramente en los síntomas, ya que no tiene acción directa en las causas de la miastenia.
Entre los efectos colaterales más comunes están los cólicos abdominales, náuseas, salivación excesiva y aumento de la sudoración.
2- Inmunosupresores
Como la MG es una enfermedad de origen autoinmune, los tratamientos más efectivos son aquellos que actúan directamente en el sistema inmunológico, inhibiendo la producción de los autoanticuerpos. Ente los medicamentos inmunosupresores más utilizados están:
- Prednisona (lea: PREDNISONA Y GLICOCORTICOIDES - Efectos Colaterales e Indicaciones).
- Azatioprina.
- Micofenolato mofetilo.
- Ciclosporina.
- Ciclofosfamida.
- Rituximab.
La desventaja de los inmunosupresores es que actúan indiscriminadamente sobre el sistema inmunológico, reduciendo la producción no sólo de los anticuerpos nocivos, sino también de los anticuerpos útiles para combatir virus y bacterias.
3- Tratamiento de la crisis miasténica
La crisis miasténica es una urgencia médica que necesita ser tratada con fármacos que tengan acción rápida. Las dos modalidades de tratamiento más comunes son:
- Plasmaferesis (lea: ¿QUÉ ES LA PLASMAFERESE?).
- Administración intravenosa de inmunoglobulina.
4- Timectomía (eliminación del timo)
El timo es un órgano del sistema inmunológico que se localiza en la región superior del tórax y es responsable de buena parte de la producción de los autoanticuerpos de MG. Cerca del 15% de los pacientes con miastenia tienen un tumor del timo, llamado timoma.
La timectomía, que es la remoción quirúrgica del timo, suele llevar a la mejora de los síntomas y hasta la cura en algunos casos, principalmente en los pacientes con timoma.
A pesar de haber una excelente respuesta inicial, la eficacia de la timectomía va cayendo con el paso de los años, ya que el timo no es el único órgano responsable de la producción de los autoanticuerpos.
Con el tratamiento adecuado, la mayoría de los individuos con miastenia gravis suele mejorar significativamente y puede llevar una vida normal o casi normal. Algunos casos pueden alcanzar remisión temporal o permanentemente, de modo que la medicación puede incluso ser interrumpida.

MAU HALITO - Causas y Tratamiento
El mal aliento, también llamado halitosis, es un problema que atormenta a la humanidad desde hace milenios. Hay informes de tratamientos para el mal aliento desde hace tres mil años. Hasta en la Biblia, en el libro Génesis, hay mención de tratamientos para refrescar el aliento. En este abordamos las siguientes cuestiones sobre mal aliento: Causas de mal aliento. Or

DOLOR CIÁTICA - Causas, Síntomas y Tratamiento
El dolor en el nervio ciático, también llamado dolor ciático, ciatalgia o, simplemente, ciática, es un dolor de origen neuropático, que ocurre cuando el nervio ciático se encuentra inflamado. El cuadro clínico clásico de la ciatalgia es de dolor lumbar con irradiación a una de las piernas, pudiendo también haber pérdida de la sensibilidad y debilidad muscular en el miembro afectado. ¿Qué es e